白金会员
白金会员
 已认证
已认证

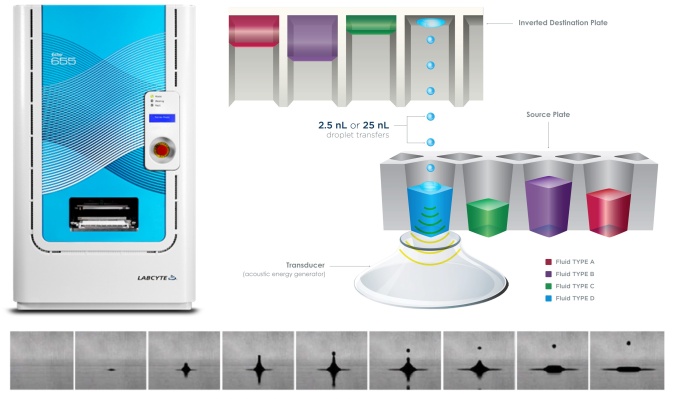
CytoFLEX nano纳米流式分析仪
是一款专门为纳米级颗粒检测设计的流式分析仪,它通过优化液路、光学、电子技术的设计提高检测灵敏度,打破了过去检测能力的限制,为研究人员打开外囊泡研究的新大门。
配备6个荧光通道和5个侧向散射通道提供单颗粒多参数数据;
表征40nm至1μm之间异质性细胞外囊泡群体;
高分辨率和高灵敏度让丰度较低的靶标也能被有效识别。
同时,为了确保每次获得一致且可重复的结果,CytoFLEX nano通过完善的自动化QC流程确保仪器性能一致,监测背景噪音以排除其对检测结果的影响,优化清洗流程实现<1%的样本间携带污染。让用户不仅可以获得想要的检测数据,更保障了数据的高质量,让研究结果更值得信赖。

CytoFLEX nano用卓越的灵敏度和分辨率、灵活的方案设计、可重复的结果和简单的操作,拓展了小颗粒的研究边界。CytoFLEX nano自2024年上市以来,目前中国研究者已发表的研究:

胞外囊泡(EVs)在药物装载与递送领域展现出临床应用前景,但规模化生产工艺的缺失阻碍了临床级产量获取,制约EV疗法的临床转化。当前EV生产主要依赖非生理性二维(2D)细胞培养或生物反应器,资源消耗显著。此外,三维(3D)与2D培养体系中EVs携带的核糖核酸(RNA)载物特征尚未明确。
来自中国医药大学的研究团队通过优化封装人胚胎肾293T细胞(HEK293T)的3D拉胀支架生物制造工艺,重点增强支架力学性能——利用生物反应器内拉伸刺激使EV产量提升约115倍,且所获EVs具有抑制肿瘤进展的特性。机制研究表明该效应由YAP/TAZ机械敏感性介导。相较于2D培养体系,3D拉胀支架经拉伸刺激的HEK293T细胞源EVs在装载阿霉素方面展现更优效能。本策略为规模化生产EVs及优化临床转化功能提供了创新路径。

神经导管作为修复周围神经损伤的优势植入体,对促进神经再生至关重要。中国医药大学的该研究将磁性3D Schwann细胞(SC)整合至聚氨酯3D打印神经导管内,构建神经元再生的优化微环境。
X射线衍射仪与傅里叶变换红外光谱证实:通过掺入氧化铁纳米颗粒(IONP)成功制备磁性三维细胞块。含IONP细胞块在静磁场作用下,表现出增强的细胞活性、增殖能力及胞外囊泡分泌功能。
神经电生理检测显示:磁场刺激下的含IONP三维细胞块可显著提升再生神经传导速度(增幅达28.7%),并缩短潜伏期至对照组65%(p<0.01)。
体内实验证实再生轴突数量增加1.8倍、密度提升2.3倍,髓鞘结构更均一且厚度增加约40%。IONP与磁场通过协同效应促进雪旺细胞分化与增殖,彰显其在周围神经损伤修复中的积极促进作用。

糖尿病伤口的特点包括慢性炎症、血管生成减少和胶原蛋白沉积不足,从而导致愈合障碍。源自脂肪间充质干细胞(ADSC)的细胞外囊泡(EVs)提供了一种前景广阔的无细胞治疗策略,但其疗效和免疫调节能力可通过生物激活进一步增强。
来自中国医药大学的研究团队开发了钙硅酸盐(CS)刺激的ADSC来源的囊泡(CSEV),并将其整合到胶原水凝胶中,创建了一个用于促进糖尿病伤口愈合的缓释系统。CSEV表现出增强的蛋白质含量、表面标志物表达,以及富含促血管生成和抗炎因子的生物活性物质。在体外实验中,与装载标准EV的胶原相比,装载CSEV的胶原能显著降低活性氧(ROS)的产生,并促进细胞增殖和迁移。细胞因子谱分析揭示了抗炎细胞因子和细胞外基质成分的上调,突显了其免疫调节和再生潜力。在体内实验中,对使用装载CSEV的胶原治疗的糖尿病兔模型进行的组织学评估显示,其具有更优的上皮再生和有序的胶原蛋白沉积,表明伤口加速闭合。这些发现强调了装载CSEV的胶原水凝胶作为一种创新且有效的治疗平台的潜力,它通过同时解决炎症和组织再生问题,来增强糖尿病伤口愈合。

放疗虽可降低癌症复发与死亡风险,但其引发的肌肉纤维化及肌无力等多重副作用,严重损害患者生存质量。然而,相关机制尚不明确。
武汉大学生命科学学院闫卫团队的本研究揭示:放疗后癌细胞通过小细胞外囊泡分泌大量亚精胺合成酶(SRM),从而诱发骨骼肌功能障碍。机制层面,辐射触发花生四烯酸(ArA)蓄积,增强SRM蛋白的ISG化修饰,进而促进SRM从原发肿瘤包装至细胞外囊泡。循环SRM通过eIF5A依赖性途径,导致骨骼肌内亚精胺累积及I型胶原纤维生物合成。氯沙坦治疗可阻断SRM的ISG化修饰及其后续分泌。综上,本研究发现放疗后ArA协同介导循环SRM分泌,通过重编程多胺代谢加剧骨骼肌纤维化,为联合氯沙坦治疗缓解放疗性肌无力提供了理论依据。

特发性肺纤维化(IPF)是一种不可逆的致命性肺部疾病,其特征为持续性肺泡上皮细胞损伤与细胞外基质沉积。早期同步调控氧化应激与炎症反应或可提供重要治疗契机。间充质干细胞来源胞外囊泡(MSC-EVs)虽具治疗潜力,但面临规模化制备与高效肺部递送的双重挑战。
来自宁波市第二医院、中国科学院宁波材料技术与工程研究所、中国科学院、同济大学、上海大学共同发表的本研究中,构建了一种用于IPF治疗的仿生胞外囊泡-球形核酸(BEV-SNA)平台:通过疏水共组装策略,将原代MSCs经机械挤压法制备的BEVs与胆固醇修饰单链DNA整合而成。在维持干性的P0-P1代MSCs中,BEVs产量较天然EVs提升17.2倍。凭借三维致密带负电的DNA外壳,BEV-SNA可减少气道粘附,实现肺部深层递送并提升细胞摄取效率。在IPF模型中,BEV-SNA展现出多阶段治疗效应:早期保护肺泡上皮细胞抵抗活性氧损伤、中期发挥抗炎活性、后期阻断纤维化进程,最终使小鼠生存率提升50%。本研究首次构建了融合天然囊泡仿生特性与球形核酸功能适配性的治疗平台,为肺部药物递送及呼吸系统疾病治疗提供新思路。
期待CytoFLEX nano的高性能表现
能助力更多外囊泡领域的前沿发现
小贝将持续追踪报道!