国家药典委:关于注射剂安全性检查法及细菌内毒素检查法应用指导原则标准草案的公示

导读国家药典委拟修订9301注射剂安全性检查法应用指导原则及9251细菌内毒素检查法应用指导原则。
中国粉体网讯 国家药典委拟修订9301注射剂安全性检查法应用指导原则及9251细菌内毒素检查法应用指导原则。为确保标准的科学性、合理性和适用性,7月24日将拟修订的9301注射剂安全性检查法应用指导原则及9251细菌内毒素检查法应用指导原则公示征求社会各界意见(详见附件)。
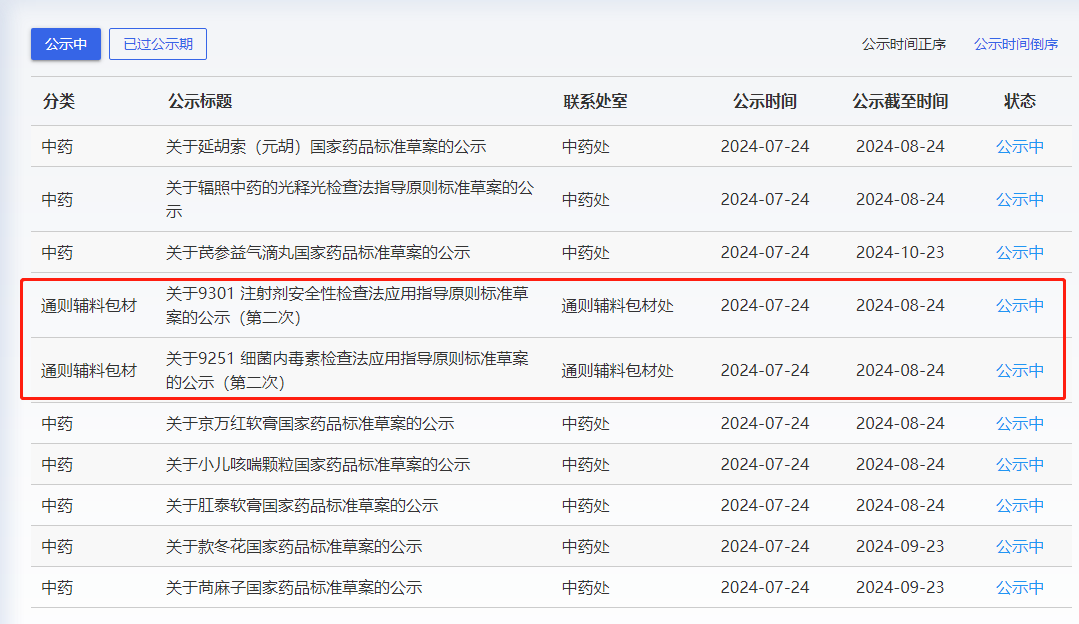
9301注射剂安全性检查法应用指导原则第二次公示稿修改说明
根据2024年4月9301注射剂安全性检查法应用指导原则首次公示稿的反馈意见和建议,国家药典委员会生物检定专业委员会进行了研讨,在第一次公示稿的基础上修订了部分内容,主要为:针对首次修订时增加的静脉用注射剂不设立异常毒性检查项的条件,在肌内注射用注射剂项下同样增加是否设立异常毒性检查项的条件,并与静脉用注射剂保持一致。
9251细菌内毒素检查法应用指导原则第二次公示稿修改说明
根据2024年5月9251细菌内毒素检查法应用指导原则首次公示稿的反馈意见和建议,国家药典委员会生物检定专业委员会进行了研讨,在第一次公示稿的基础上修订了部分内容,主要为:
1.在“细菌内毒素限值的设定”项下,(5)制定原辅料和药包材的细菌内毒素限值时调整了叙述。
2.在3.供试品的前处理方法项下,关于药包材的前处理方法,增加了“采用其他器皿”和“采用其他方法制备供试液”的要求描述。
3.在3.供试品的前处理方法项下,将表1的表头中的“前处理方法”改为“排除措施”,并将葡聚糖明确为β-葡聚糖,与通则1143的叙述保持一致。
4.在5.3中,删去了对环境清洁度的要求。
5.在5.4低内毒素回收项下,明确了需要时再进行低内毒素回收的研究。
6.增加了5.5对细菌内毒素检查法所用鲎试剂应符合相应质量要求。
参考来源:国家药典委员会
(中国粉体网编辑整理/青黎)
注:图片非商业用途,存在侵权告知删除
| 附件一:附件 9301 注射剂安全性检查法应用指导原则公示稿(第二次).pdf, 586KB |
| 附件二:附件 9251细菌内毒素检查法应用指导原则公示稿(第二次).pdf, 767KB |
文章评论
相关资讯
粉体大数据研究

15255

18

0